口罩产品出口韩国需要做哪些资料和认证?
韩国口罩主要分为保健用口罩、手术用口罩和防护口罩。保健用口罩按照过滤效率分为KF88级、KF94级和KF99级;手术用口罩暂无分类;防护口罩按照隔离粉尘类型分为特级、1级、2级三个等级,按照过滤元件连接方式分为分离式和随弃式,其中分离式又分为隔离式和直接连接式,按照覆盖范围分为全面罩、半面罩。
保健用和手术用口罩属于医药外品,按照医药外品许可类管理;防护口罩属于工业防护用品,上市前需获得KCs认证。
|
类别 |
等级 |
审批分类 |
|
保健用口罩 |
KF80、KF94、KF99 |
医药外品 许可类 * |
|
手术用口罩 |
- |
医药外品 许可类 * |
|
防护口罩 |
特级、1级、2级; 分离式(隔离式、直接连接式),随弃式; 全面罩、半面罩 |
KCs 认证 |
|
普通口罩 |
- |
|
|
* 医药外品审批包括许可类和备案类,保健用口罩和手术用口罩都属于许可类。 |
||
二、韩国口罩监管要求
|
分类 |
保健用口罩、手术用口罩 |
防护口罩 |
|
监管部门 |
食品医药品安全处(MFDS) |
安全保健公团(KOSHA) |
|
审批部门 |
食品医药品安全处(MFDS) |
产业安全保健认证院(OSHCI) |
|
审批分类 |
医药外品许可 |
KCs认证 |
|
法规依据 |
《药事法》 《药事法施行令》 《医药品等制造业及进口商设施基准令》 《医药品等制造业及进口商设施基准令施行规则》 《医药品等安全相关规则》 |
《产业安全保健法》 《产业安全保健法施行令》 《产业安全保健法施行规则》 《防护用品安全认证公告》 |
三、韩国口罩过滤效率对比
|
分类 |
韩国保健用口罩 |
韩国防护口罩(随弃式) |
中国防护口罩(随弃式) |
|||||
|
过滤效率 |
KF80 |
≥80 % (氯化钠颗粒物) |
2级 |
≥80 % (氯化物&石蜡油颗粒物) |
KN90 |
≥90.0 % (氯化钠颗粒物) |
KP90 |
≥90.0 % (油类颗粒物) |
|
KF94 |
≥94 % (氯化物&石蜡油颗粒物) |
1级 |
≥94 % (氯化物&石蜡油颗粒物) |
KN95 |
≥95.0 % (氯化物颗粒物) |
KP95 |
≥95.0 % (油类颗粒物) |
|
|
KF99 |
≥99 % (氯化物&石蜡油颗粒物) |
特级 |
≥99 % (氯化物&石蜡油颗粒物) |
KN100 |
≥99.97 % (氯化物颗粒物) |
KP100 |
≥99.97 % (油类颗粒物) |
|
四、韩国口罩的申报流程
1.保健用口罩&手术用口罩的常规申报流程(以进口产品为例)
|
流程 |
周期 |
提交资料 |
|
|
申报环节 |
①进口商申报医药外品进口资质 |
- |
*取得《医药外品进口业备案证》 |
|
②出口商与进口商签订合同。 |
|||
|
③制定产品标准 |
70天 |
- |
|
|
④产品检测 |
产品标准和检测方法 |
||
|
⑤医药外品产品许可申报 |
1)生产证明 2)销售证明 3)产品设计开发的研究资料 4)产品标准和检测方法、产品检测报告 5)稳定性研究资料(长期保存试验资料或者加速试验资料) 6)生物学评价资料 7)功能&效果证明资料 8)国外使用现况相关资料 7)与韩国国内同类产品的比对审核等 *取得《医药外品产品许可证(进口类)》 |
||
|
进口环节 |
⑥向韩国医药品进出口协会报告通关 |
- |
*签发《标准通关预受理证》 |
|
⑦海关进口申报 |
- |
*签发《进口申报单》 |
|
|
⑧产品检测(进口检验) |
30天 |
*在指定检测机构进行检测 |
|
|
⑨流通、销售 |
- |
- |
|
*因进口医药外品许可证是签发给韩国进口商的,出口企业可选择有进口资质、不参与实际贸易的企业作为名义进口商,可以避免贸易商独揽产品的进口许可权。
2.疫情期间保健用口罩的快速申报、快速通关流程
|
流程 |
周期 |
提交资料 |
|
|
申报环节 |
①进口商申报医药外品进口资质 |
25天 |
*取得《医药外品进口业备案证》 |
|
②出口商与进口商签订合同,由进口商进行以下操作。 |
|||
|
③医药外品产品许可申报 |
1个月 |
1)生产证明 2)销售证明 3)KN95检测报告(GB2626) 4)其他产品检测报告 5)相关认证证书(如有,请提供) 6)产品设计开发的研究资料 7)稳定性研究资料 8)生物学评价资料 9)国外使用现况相关资料 备注: * 1)- 5)项为快速许可的必须资料。 6)- 9)可暂缓提供,但不得晚于6月30日,6月30日之前未能提交时取消许可。 * 取得《 医药外品产品许可证(进口)》 |
|
|
进口环节 |
④向韩国医药品进出口协会报告通关 |
- |
签发《标准通关预受理证》 |
|
⑤海关进口申报 |
- |
签发《进口申报单》 |
|
|
⑥产品检测(进口检验) |
30天 |
*在指定检测机构进行检测 |
|
|
⑦流通、销售 |
- |
- |
|
3.防护口罩(以进口产品为例)
|
认证流程 |
周期 |
提交资料/审核资料 |
|
①出口商选定韩国代理人 |
- |
委托书 |
|
②资料形式审核 |
30天 |
1)营业执照 2)进口证明 3)代理人委托书 4)口罩明细及使用说明书 5)口罩结构图、配件图 6)口罩照片、配件照片 |
|
③技术审核和生产体系审核
|
45天 |
1)质量管理体系的建立和实施方法 2)产品安全性的确认程序及内容 3)生产管理和产品出库前后的管理程序和管理内容 4)生产和服务的改进程序 5)配件和产品的识别管理方剂及产品保存方法 6)生产监控、检测设备及设备管理办法 7)生产过程数据分析及预防和改善方法 8)不合格品处理程序 |
|
④产品检测 |
60天 |
1)③的审核结果通知书 2)④的审核结果通知书 3)口罩材料检测报告 |
五、口罩韩国申报预期周期
|
项目 |
认证周期 |
证书名称 |
证书有效期 |
|
保健用口罩 |
常规申报:2-3个月 快速申报:1个月左右 |
医药外品产品许可证(进口) |
不设有效期 |
|
手术用口罩 |
|||
|
防护口罩 |
5-6个月 |
KCs安全认证证书 |
不设有效期 (定期审核) |
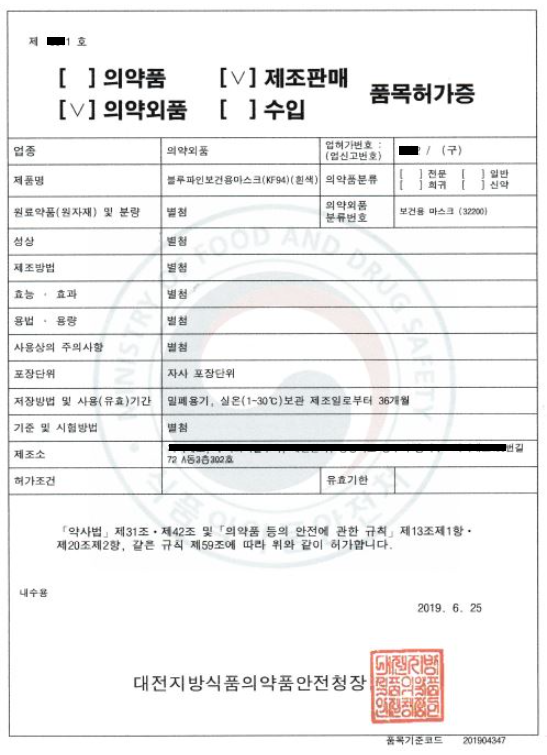
附:口罩韩国证书
1. 口罩 医药外品产品许可证
2. 防护口罩KCs安全认证证书

